Biografi Niels Bohr
Niels Bohr (lahir di Kopenhagen, Denmark, 7 Oktober 1885) –
dan merupakan anak dari Christian Bohr seorang professor Fisiologi di Universitas Kopenhagen. Niels Bohr adalah seorang ahli fisika dari Denmark dan pernah meraih hadiah Nobel Fisika pada tahun 1922.
dan merupakan anak dari Christian Bohr seorang professor Fisiologi di Universitas Kopenhagen. Niels Bohr adalah seorang ahli fisika dari Denmark dan pernah meraih hadiah Nobel Fisika pada tahun 1922.
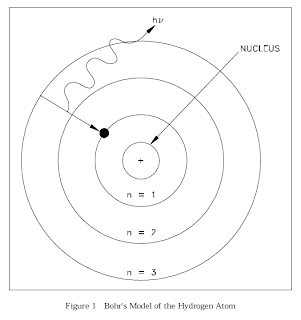
Pada tahun 1913, Bohr menerapkan konsep mekanika kuantum untuk model atom yang telah dikembangkan oleh Ernest Rutherford, yang menggambarkan bahwa atom tersusun dari inti atom (nukleus) yang dikelilingi oleh orbit elektron.
Anak laki-lakinya, Aage Niels Bohr, juga penerima Hadiah Nobel.
Di tahun 1911 Bohr meraih gelar doktor fisika dari Universitas Copenhagen. Tak lama sesudah itu Bohr pergi ke Cambridge, Inggris. Di situ Bohr belajar di bawah asuhan J.J. Thompson, ilmuwan kenamaan yang menemukan elektron. Hanya dalam beberapa bulan sesudah itu Bohr pindah lagi ke Manchester, belajar pada Ernest Rutherford yang beberapa tahun sebelumnya menemukan nucleus (bagian inti) atom. Adalah Rutherford ini yang menegaskan (berbeda dengan pendapat-pendapat sebelumnya) bahwa atom umumnya kosong, dengan bagian pokok yang berat pada tengahnya dan elektron di bagian luarnya. Tak lama sesudah itu Bohr segera mengembangkan teorinya sendiri yang baru serta radikal tentang struktur atom.
Niels Bohr meninggal di Kopenhagen, Denmark, 18 November 1962 pada umur 77 tahun)
Model Atom Bohr
Para ilmuwan menyadari bahwa model atom Rutherford bersifat tidak stabil karena bertentangan dengan hukum Fisika klasik dari Maxwell. Menurut hukum tersebut jika partikel bermuatan, dalam hal ini elektron bergerak mengelilingi inti atom yang mempunyai muatan berlawanan, maka elektron tersebut akan mengalami percepatan dan memancarkan energi berupa gelombang elektromagnetik. Hal ini menyebabkan energy elektron semakin berkurang. Akibatnya, jari-jari lintasan elektron berkurang, membawa elektron mendekati inti dalam lintasan berbentuk spiral. Pada suatu saat, elektron tidak mampu lagi mengimbangi gaya tarik oleh inti sehingga akan bergabung ke inti. Pada kenyataannya, elektron tidak bergabung dengan inti dan atom bersifat stabil.
Di tahun 1913, Niels Bohr berhasil memperbaiki kelemahan model atom Rutherford. Hal ini diawali dari pengamatannya terdapat pada spektrum atom
1. Spektrum Atom
Apabila elektron bergerak mengelilingi inti dengan lintasan berbentuk spiral adalah benar, maka energi yang dipancarkan oleh elektron seharusnya memberikan spektrum yang bersifat kontinyu.
Pada tahun 1913, Bohr menggunakan teori kuantum Planck untuk mengemukakan postulatnya untuk menjelaskan kestabilan atom dan spektrum atom hidrogen.
Tetapi sementara itu teori struktur atom Bohr menghadapi kekurangan. Masalah terpokok adalah bahwa teori Bohr, meskipun dengan sempurna menjelaskan kesulitan masa depan atom (misalnya hidrogen) yang punya satu elektron, tidak dengan persis memperkirakan spektra dari atom-atom lain. Beberapa ilmuwan, terpukau oleh sukses luar biasa teori Bohr dalam hal memaparkan atom hidrogen, berharap dengan jalan menyempurnakan sedikit teori Bohr, mereka dapat juga menjelaskan spektra atom yang lebih berat. Bohr sendiri merupakan salah seorang pertama yang menyadari penyempurnaan kecil itu tak akan menolong, karena itu yang diperlukan adalah perombakanradikal. Tetapi, bagaimanapun Bohr mengerahkan segenap akal geniusnya, dia tidak mampu memecahkannya
Model atom Bohr telah memperkenalkan konsep bilangan kuantum n yang menyatakan orbit atau kulit atom, yakni n = 1, 2, 3 … yang disebut juga kulit K, L, M …. Susunan elektron dalam kulit-kulit atom disebut konfigurasi elektron aturan konfigurasi elektron untuk atom-atom Z ≤ adalah:
- Kulit K hanya dapat memuat maksimum 2 elektron, sedangkan kulit L dan M dapat memuat 8.
- Untuk atom unsur Z = 19 dan Z = 20, pengisian elektron sampai ke kulit N elektron.
Kelebihan dan Kekurangan atom Bohr:
Kelebihan:
- Keberhasilan teori Bohr terletak pada kemampuannya untuk meramalkan garis-garis dalam spektrum atom
hidrogen
- Salah satu penemuan adalah sekumpulan garis halus, terutama jika atom-atom yang dieksitasikan diletakkan
pada medan magnet.
- Dalam orbital tertentu, energi elektron adalah tetap. Elektron akan menyerap energi jika berpindah ke orbit yang lebih
luar dan akan membebaskan energi jika berpindah ke orbit yang lebih dalam
Kelemahan:
- Struktur garis halus ini dijelaskan melalui modifikasi teori Bohr tetapi teori ini tidak pernah berhasil memerikan
spektrum selain atom hydrogen- Belum mampu menjelaskan adanya stuktur halus(fine structure) pada spektrum, yaitu 2 atau lebih garis yang
sangat berdekatan.
- Belum dapat menerangkan spektrum atom kompleks, Intensitas relatif dari tiap garis spektrum emisi, serta Efek
Zeeman, yaitu terpecahnya garis spektrum bila atom berada dalam medan magnet.
Source: berbagai sumber












.jpg)
.jpg)











